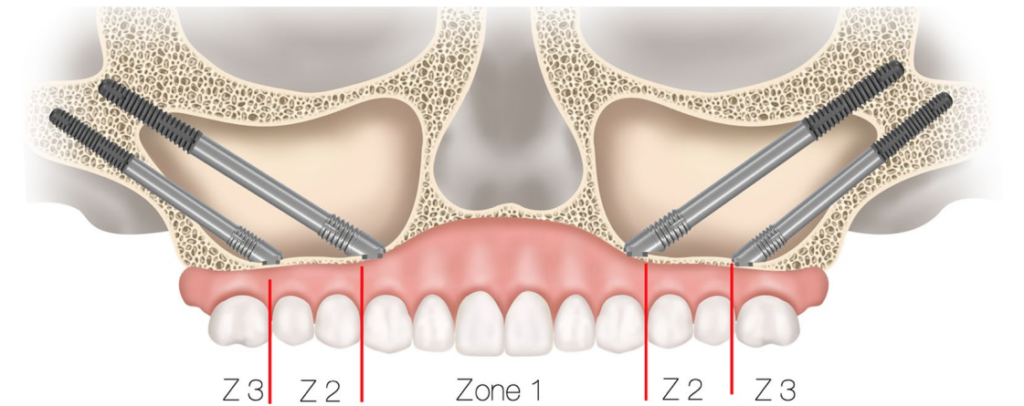
ザイゴマインプラントに関連した論文
本日紹介する論文は、

~はじめに~
今回ご紹介するのは2025年1月にJournal of Clinical Medicineにて報告されたこちらの論文です:ザイゴマインプラントと骨膜下インプラントの5年間比較研究:重度の上顎骨萎縮における臨床成績、合併症、および治療戦略。最低5年間のフォローアップを通して、ザイゴマインプラントと骨膜下インプラントの生存率、補綴の成功度、合併症について比較検討した文献になります。骨膜下インプラントは現在主流の骨内インプラントが紹介されてから使われる機会が減りましたが、近年CADを利用した骨膜下インプラントのデザインが発達し、重度の骨吸収を認める患者において再注目されております。現在ザイゴマ インプラントの治療をされている先生方、サブペリオステアルインプラントのご経験のある先生方、ザイゴマインプラント治療を検討されている先生方には是非読んで頂きたい論文です。
1.緒言
上顎骨が萎縮した患者に対するリハビリテーションは、顎顔面領域を扱う歯科医師において依然として大きな課題である。従来の骨移植術、骨再生、上顎洞挙上術は有効な解決策を提供してきたが、治療期間の長期化、患者の罹患率の増加、さらには高額な費用を伴うことが多い [1,2]。そのため、骨量が不足する患者に対しては、ザイゴマインプラントや骨膜下インプラントといった代替的アプローチが有望な解決策として登場している。
ザイゴマインプラントは重度に萎縮した上顎骨に対する解決法として導入され、広範囲の骨移植を必要とせずに頬骨に固定される [3,4]。その独自のデザインにより、即時荷重と治療期間の短縮が可能となっている。術前計画や成功率の評価には、Zygomatic Anatomy-Guided Approach (ZAGA) や ORIS 基準が広く受け入れられている [5]。しかし、上顎洞への貫通や眼窩底の穿孔といったリスクはいまだに大きな懸念点である [6]。
一方、骨膜下インプラントは20世紀半ばに初めて開発されたが、近年はデジタル画像技術や3Dプリンティングの進歩により再び注目されている。このインプラントは骨膜下で骨表面に直接設置され、固定用スクリューで安定化されるため、骨内インプラントの適用が不可能な重度萎縮症例に適している [7,8]。近年の革新として、安全性が検証されたカスタムデザインのインプラントがレーザー焼結法により製作されるようになり、適合性の向上と術中合併症の減少に寄与している [9,10]。
両インプラントタイプの臨床的成功は、現在も比較研究が不足している。ザイゴマインプラントは即時荷重と骨移植を伴わない術式の利点を有する一方で、骨膜下インプラントは上顎洞に関わるリスクを避けつつ、重度に萎縮した上顎骨に対して個別化されたアプローチを提供する [6,7]。インプラントの安定性、軟組織のマネジメント、患者固有の解剖学的条件、ならびに手術の複雑性といった要因を評価することは、適切な治療法を選択する上で極めて重要である [11]。
従来のインプラント外科戦略、すなわち上顎洞挙上術やGBRは、重度上顎骨萎縮患者にとって有効な選択肢であるものの、治療期間の長期化や患者の罹患率増加と関連している。本研究は、こうした臨床的ギャップに対処するため、ザイゴマインプラントと骨膜下インプラントの長期比較解析を行い、それぞれの利点・限界・安全性に関する知見を提供することを目的としている。
2. 材料と方法
2.1. 研究デザイン
本研究で行なった後ろ向きコホート研究は、重度上顎骨萎縮の治療において骨膜下インプラントで治療を受けた患者と、ザイゴマインプラントで治療を受けた患者との臨床成績を比較することを目的とした。本研究は単一の歯科インプラント専門クリニックで実施され、2010年から2023年に治療を受けた患者を対象とした。全ての患者は術後少なくとも5年間のフォローアップを受けている。
主要評価項目は以下の通りである:
インプラント生存率:インプラント撤去の有無で定義
補綴の成功:補綴物の安定性と機能性
合併症:インプラント露出、反復する腫脹、インプラント周囲軟組織の健康状態、ならびに副鼻腔関連合併症(例:副鼻腔炎または粘膜肥厚)の発生
本研究は倫理審査委員会の承認を受け、全参加者からインフォームドコンセントを取得したうえで実施された。
2.2. 統計解析
統計解析には Statgraphics Centurion version 18.1.12(StatPoint Technologies, Warrenton, VA, USA)を用いた。使用した統計手法は Mann–Whitney U 検定、Kruskal–Wallis 検定、Fisher検定、ANOVA である。p < 0.05 の場合に統計学的に有意と判定した。
2.3. 患者選択
本研究に含める患者は、結果の妥当性と関連性を確保するため、いくつかの基準を満たす必要があった。対象は 35歳から80歳まで の患者で、Cawood 分類 V または VI に該当する重度上顎骨萎縮と診断された者とした。すべての参加者は、スクリュー固定式ブリッジによる補綴を伴う骨膜下またはザイゴマインプラント治療を受けていた。術前および術後の CBCT画像を含む完全な治療記録が必須条件であり、術後少なくとも 5年間のフォローアップを受けていることが求められた。さらに、インプラントの予後に影響を与える可能性のある 制御不能な全身疾患が存在しない良好な全身健康状態 であることが前提条件とされた。
また、研究の信頼性を確保するために厳格な除外基準を設けた。喫煙者、または手術6週間前までに禁煙していない者は除外した。コントロール不良の糖尿病(HbA1c > 7.5%)や骨代謝に影響を及ぼす既知の全身疾患を有する患者も除外した。さらに、頭頸部への放射線治療歴がある者も、インプラント成功に影響する可能性から対象外とした。フォローアップデータが不完全な患者、または追跡調査への協力が不十分な患者も研究対象から除外された。
骨膜下インプラント群では、同一歯槽部での同時抜歯および骨膜下インプラント埋入を行った症例は除外した。一方、ザイゴマインプラント群では、一部の患者において 抜歯とインプラント埋入を同時に施行した症例が含まれている。
これらの基準により、骨膜下インプラントとザイゴマインプラントの成績を評価するための、均質かつ信頼性の高い患者コホートが確保された。
2.4. 患者コホート
研究対象は、治療に用いられたインプラントの種類および構成に基づき、明確に区分されたグループに分けられた(Table 1)。
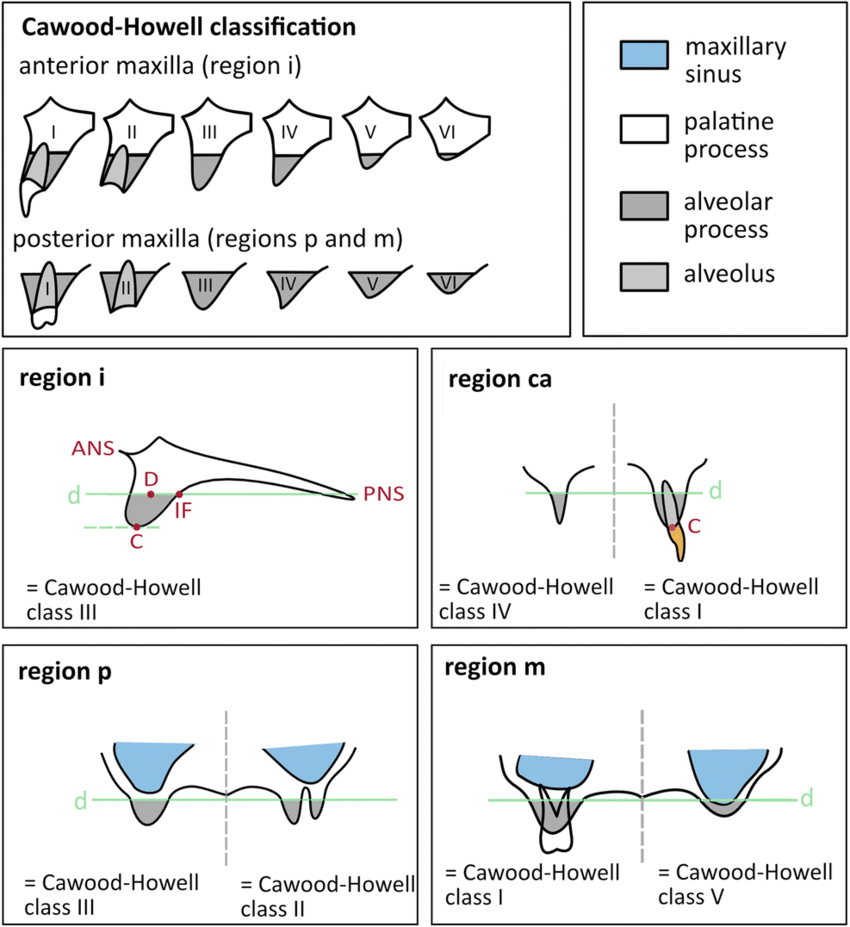
参考資料:Cawood-Howell 分類 歯槽堤の分類をクラスⅠからクラスⅥまで分けている
サブペリオステアルインプラント群
89名の患者が、インプラントの構成に応じて3つのサブグループに分類された:
グループ1:51名 ― 各3本のマルチユニットを備えた2つの個別骨膜下インプラントで治療
グループ2:24名 ― 各2本のマルチユニットを備えた2つの個別骨膜下インプラントと、1~2本の従来型インプラントを併用
グループ3:14名 ― 2~4本のマルチユニットを備えた単一の骨膜下インプラントで治療
ザイゴマインプラント群
81名の患者が、インプラントの本数と配置に基づいて4つのグループに分類された:
グループ1:14名 ― 4本のザイゴマインプラントと1~2本の従来型インプラントを併用
グループ2:15名 ― 4本のザイゴマインプラントのみで治療
グループ3:46名 ― 2本のザイゴマインプラントと4本の従来型インプラントを併用
グループ4:6名 ― 3本のザイゴマインプラントと1~2本の従来型インプラントを併用
このような詳細な分類により、インプラント構成とその治療結果を精緻に分析することが可能となった。骨膜下インプラント群とザイゴマインプラント群の各グループは、それぞれ特有の特徴と治療プロトコールを有しており、比較評価における強固な基盤を提供した。
均一性を確保するため、すべての手術は骨膜下およびザイゴマインプラントの埋入技術に熟練した1人の術者によって行われた。術前のCBCT撮影を用いて手術計画を行い、また重度の上顎骨萎縮を確認することで、患者選択の一貫性を担保した。
2.5. 手術手技
2.5.1. 骨膜下インプラント
サブペリオステアルインプラントは、先進的なデジタルワークフローを用いてカスタム設計された。術前のCBCT画像により、患者ごとの上顎形態に適合した詳細な解剖学的データを取得し、設計に反映させた。すべての患者において、インプラントは無歯顎の上顎に使用された。個別インプラントと同時に抜歯が行われた症例では、インプラントの枝(rami)は抜歯窩を覆うようには延長されなかった。インプラントは医療用チタン合金を材料とし、直接金属レーザー焼結(DMLS)技術を用いて製作された。
術前準備
すべての患者に対して、術前24時間前にペニシリン1 gを投与し、その後7日間、12時間ごとに投与を継続した。手術は患者および手術の複雑さに応じて、鼻挿管による全身麻酔またはエピネフリン添加アーティカインによる局所麻酔下で行われた。
手術手技
切開は片側の上顎結節から反対側の上顎結節まで両側性に歯槽堤上に行われた。続いて、粘膜骨膜弁を口蓋側に全層で剥離し、歯槽堤および下頬骨稜を明示し、骨へのアクセスを確保した。逆ラングベックリトラクターを用い、眼窩下神経を温存しつつ慎重に頬骨へのアプローチを行った。
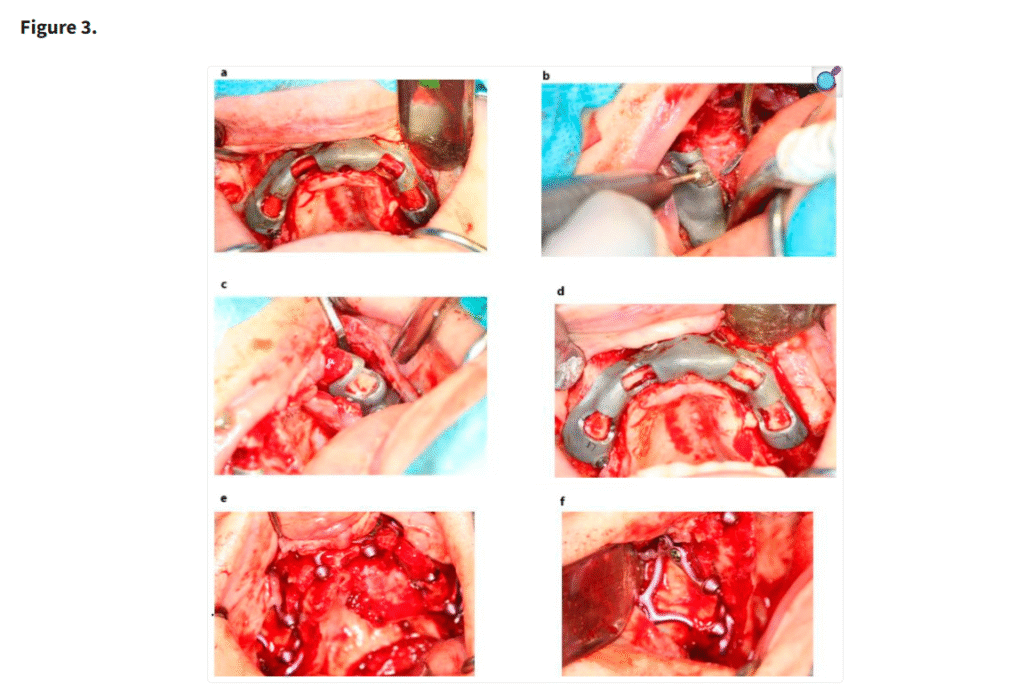
十分な視野が得られた段階で、患者の上顎解剖に正確に適合するように設計されたカスタムサブ骨膜下インプラントを歯槽堤上に配置した(Figure 1)。一部の症例では、歯槽堤が狭く高い場合にテンプレートを用いて骨を削除した(Figure 2・Figure 3)。手術中に頬脂肪体が脱出した場合には、MaIインプラント®(Integra Implants®, ロッジ、ポーランド)の前庭側表面に縫合した(Figure 4)。また一部の症例では、オトガイ部や外斜線から骨片を採取し、MaIインプラントの枝を覆う目的で使用した(Figure 5)。
インプラントは、直径2.0 mmまたは2.2 mmの自己穿孔型スクリュー(緑または紫に陽極酸化処理されたもの)で固定した。スクリューは頬骨、口蓋、鼻下部、中口蓋縫合部など複数の固定点に戦略的に配置された。スクリューの長さは6 mmから13 mmまで選択され、各部位の骨密度に基づいて決定された。トルク値は骨の硬さに応じて調整され、Type IVの柔らかい骨では5 Ncm、Type Iの硬い骨では30 Ncmとし、最適な安定性を確保した。
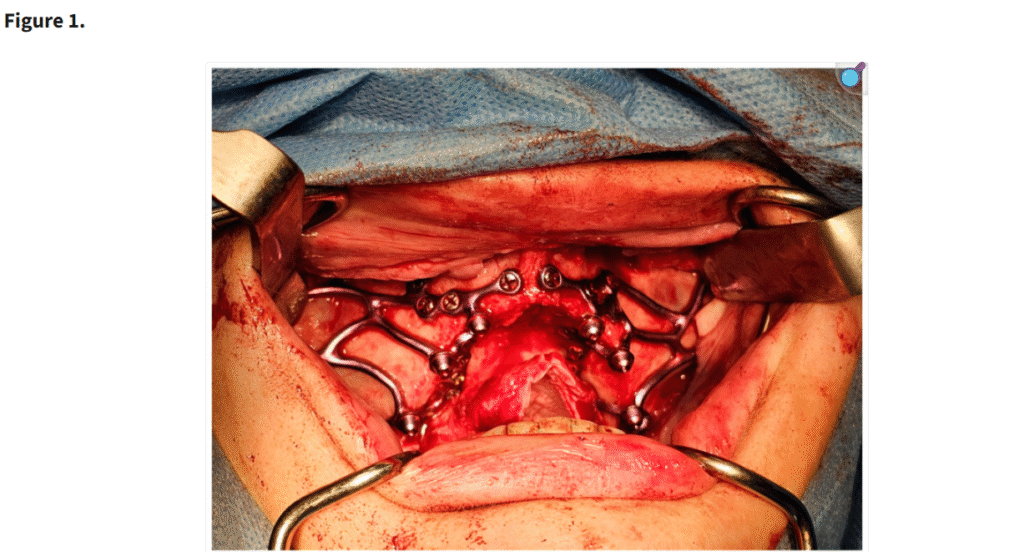
「セルフタッピングスクリューで固定された MaI インプラント®(Integra Implants®, ロッツ〔ポーランド〕)の埋入。写真は、自家骨片でインプラントを被覆する前に撮影されたものである。」
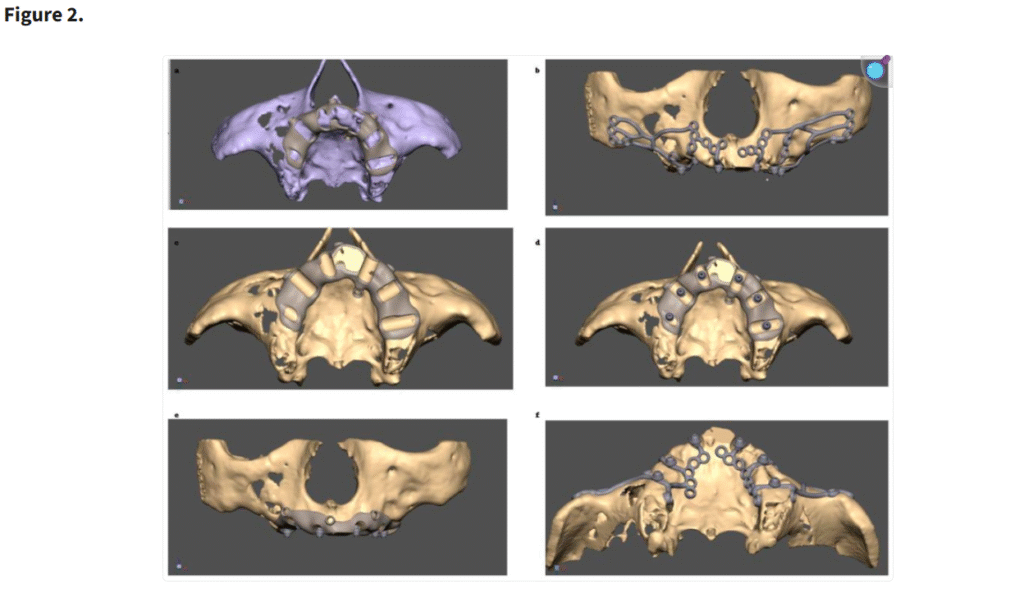
歯槽堤の骨削除用テンプレートの設計プロセス
(a) 骨削除前に歯槽堤にテンプレートを装着
(b, f) 骨上に設置された MaI インプラント®(Integra Implants®, ロッツ〔ポーランド〕)
(c) 骨削除後に歯槽堤にテンプレートを装着
(d, e) 骨削除後の骨上に設置されたマルチユニット
テンプレートの臨床応用(a–d)と、骨整形後の MaI インプラント®(Integra Implants®, ロッツ〔ポーランド〕)の埋入(e, f)
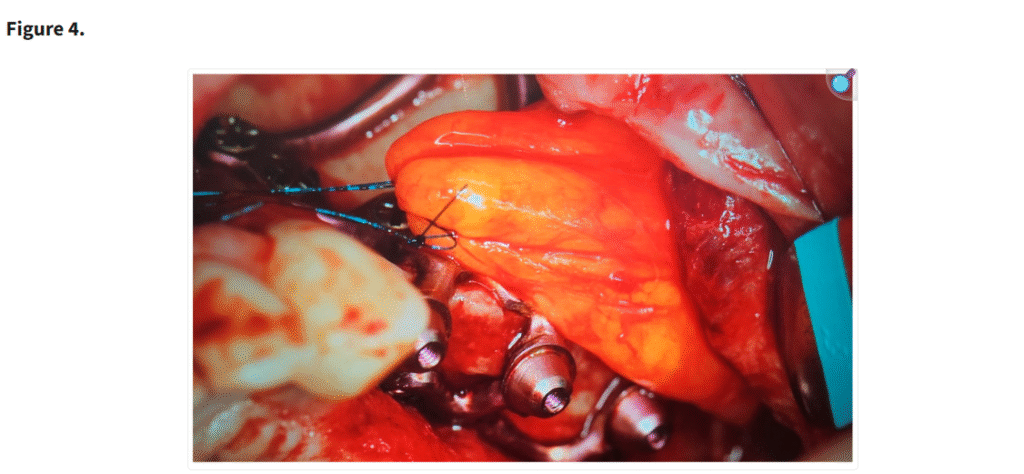
MaI インプラント®(Integra Implants®, ロッツ〔ポーランド〕)上に覆われた頬脂肪体。脂肪体は吸収性縫合糸を用いて縫合することができ、その場合は骨膜に固定される。あるいは非吸収性縫合糸を用いて縫合することも可能であるが、この場合は結紮部を歯肉の上に残し、最低10日後に抜糸できるようにしなければならない
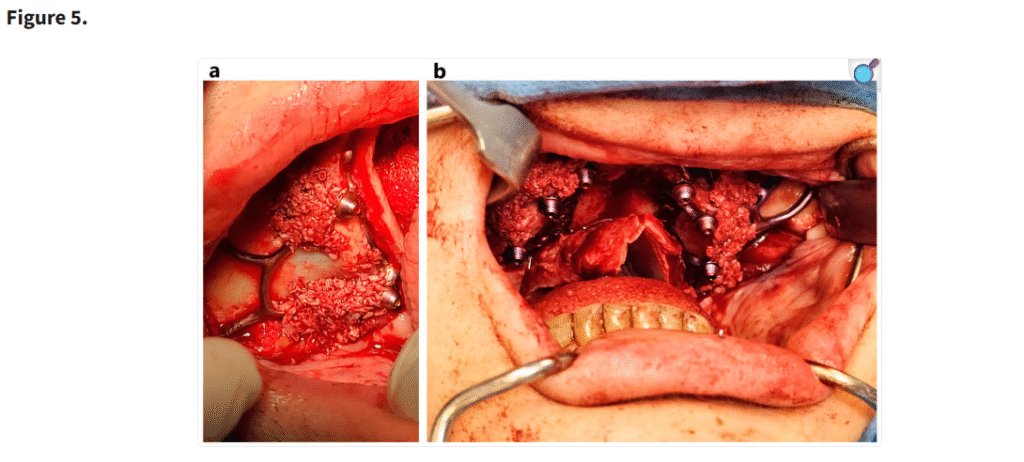
(a, b) 使い捨てのボーンスクレーパーを用いて骨片を採取し、MaI インプラント®(Integra Implants®, ロッツ〔ポーランド〕)のラミ部に填入した。骨片の目的は、MaI インプラント®の裂開リスクを低減することであった。
剥離中に軟組織の下層が確認された場合、あるいは頬脂肪体が露出した場合には、脂肪体を採取して縫合し、追加の被覆とインプラント統合の促進を図った。手術は精密に行われ、平均手術時間は約174分、標準偏差は±43分であった。
術後管理
術後には、すべての患者に対し24時間以内にスクリュー固定式の仮アクリルブリッジを装着し、即時の機能回復および審美性の改善を実現した。全身麻酔下で手術を受けた患者には、炎症および術後腫脹を軽減する目的で、術中にデキサメタゾン(8 mg)を単回投与した。
患者は術後のフォローアップに来院するよう指導され、抜糸は手術から2週間後に行われた。術後5か月で最終補綴装置が製作・装着され、これにはチタンにアクリルを結合したブリッジ、CoCrにポーセレンを結合したブリッジ、あるいはチタン構造上にジルコニアを全面築成したブリッジなどが含まれ、患者ごとのニーズに合わせた耐久性と高品質を備えた修復が提供された。
2.5.2. ザイゴマインプラント
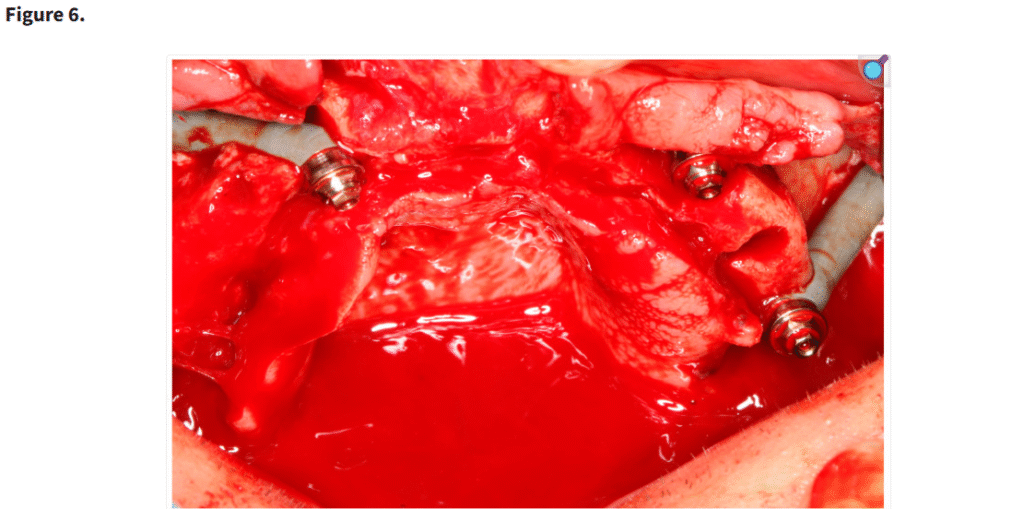
ザイゴマインプラントは、「サイナススロットアプローチ」とエクストラサイナス技法を組み合わせて使用し、最適なインプラント固定と補綴的支持を得た(Figure 6)
エクストラマキシラリー法によるザイゴマインプラント埋入
術前準備
予防的抗菌薬は骨膜下インプラントと同じレジメンで投与された。すべての手術は全身麻酔下で経鼻挿管により行われ、患者の快適性と術中の精度を確保した。
手術手技
切開は片側の上顎結節から反対側の上顎結節まで歯槽頂に沿って行い、術野全体への十分なアクセスを確保した。口蓋弁を慎重に剥離し、本手技において重要な解剖学的ランドマークである歯槽突起および頬骨下稜を露出させた。
一部の症例では、長期的な統合を最適化し、軟組織の被覆を強化するために、ザイゴマインプラントの表面に骨片を添加した。このアプローチは標準的に必須とされるものではないが、臨床的判断および患者ごとのニーズに基づき選択的に適用された。本手技を示す高解像度写真をFigure 7に掲載した。
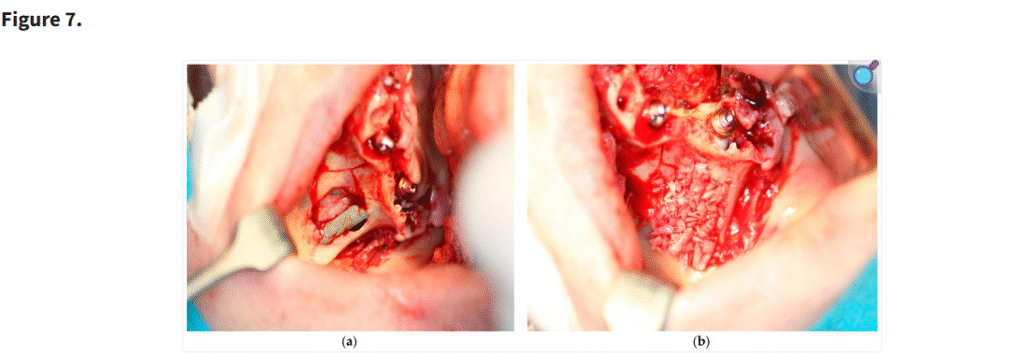
この写真は、ステラ法によるザイゴマインプラントの埋入(a)と、前方上顎洞から採取した骨片をザイゴマインプラント上に填入し、インプラントを骨膜から隔離するために用いた様子(b)を示している
正確なインプラント埋入を可能にするため、ダイヤモンドバーを用いて側方上顎洞ウィンドウを作製した。この操作により、上顎洞天蓋の直視下での確認が可能となり、インプラントの安全かつ正確な位置決めが容易になった。上顎洞粘膜は穿孔や損傷を避けるために慎重に挙上され、インプラント挿入のための明確な経路が確保された。
頬骨へのドリリングは、回転数600 rpmに制御されたインプラント用ハンドピースを用いて行われた。その後、Nobel Biocare社製のザイゴマインプラント(TiUnite表面、45度アングル、直径4.3 mm)が埋入された。インプラントの長さは患者ごとの解剖学的条件に基づき、30 mmから52.5 mmの範囲で選択された。
各インプラントの上顎および上顎洞との位置関係は慎重に記録された。埋入位置は、構造物に対する位置に基づき「洞内型または洞外型」「上顎内型または上顎外型」に分類された。これにより、インプラントの方向性および周囲解剖構造との統合に関する詳細な理解が保証された。
術後管理
術後24時間以内にスクリュー固定式の仮アクリルブリッジが装着された。最終補綴修復は術後5か月で製作・装着され、患者は5年間の定期的なフォローアップを受けた。フォローアップでは、インプラントの安定性、上顎洞の健康状態、および補綴機能に重点が置かれた。
3. 結果
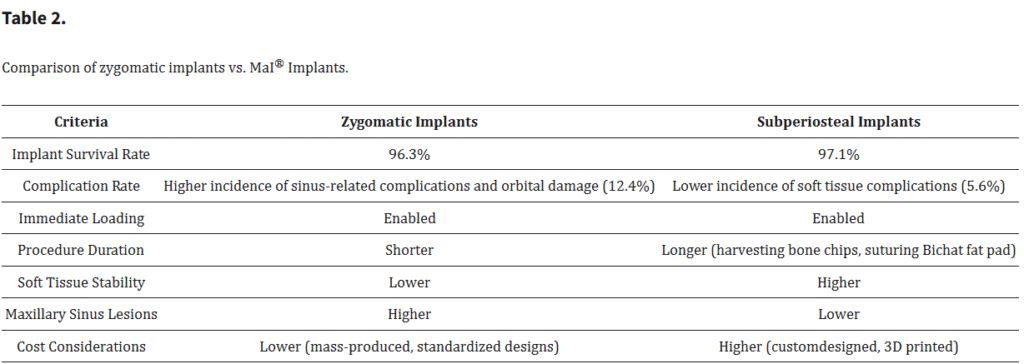
骨膜下インプラントとザイゴマインプラントの比較にあたり、いくつかの基準が考慮された(Table 2)。
これらの写真は、上顎左側3番付近のザイゴマインプラント周囲に生じた軟組織裂開(a, b)を示している。インプラントをバーで平滑化した後、口蓋からの有茎弁で露出したインプラントを被覆しようと試みた(c)。しかし再び歯肉が露出し、上顎洞炎の再発を理由にインプラントを除去する判断となった。インプラントを除去した後(d)、生じた欠損部は頬脂肪体で被覆された(e, f)
3.1. インプラントの失敗
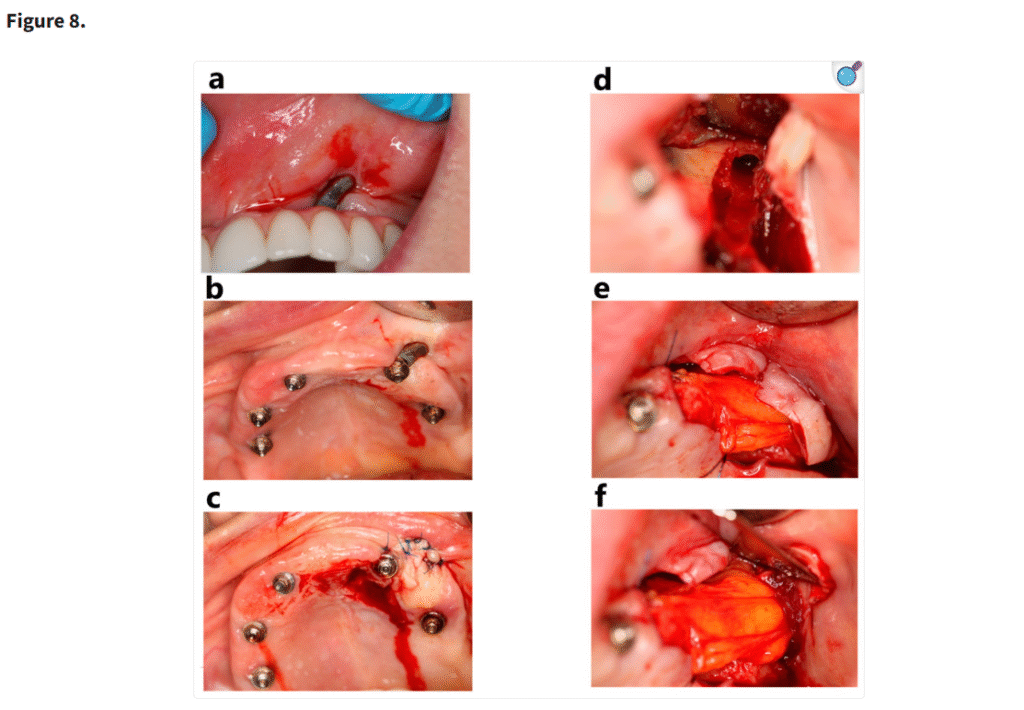
重度の上顎萎縮症例において、個別設計のインプラントはザイゴマインプラントと比較して低い失敗率を示した(Figure 8)。ザイゴマインプラントの生存率(96.3%)と骨膜下インプラントの生存率(97.1%)との間に統計学的に有意な差は認められなかったものの(p = 0.278)、骨膜下インプラントのわずかに高い生存率は、その患者固有の解剖学的形態に適合するカスタマイズ設計によるものと考えられる。この個別化アプローチにより、インプラントおよび周囲骨への応力集中が軽減され、安定性および長期的な統合が向上した(Figure 9)。
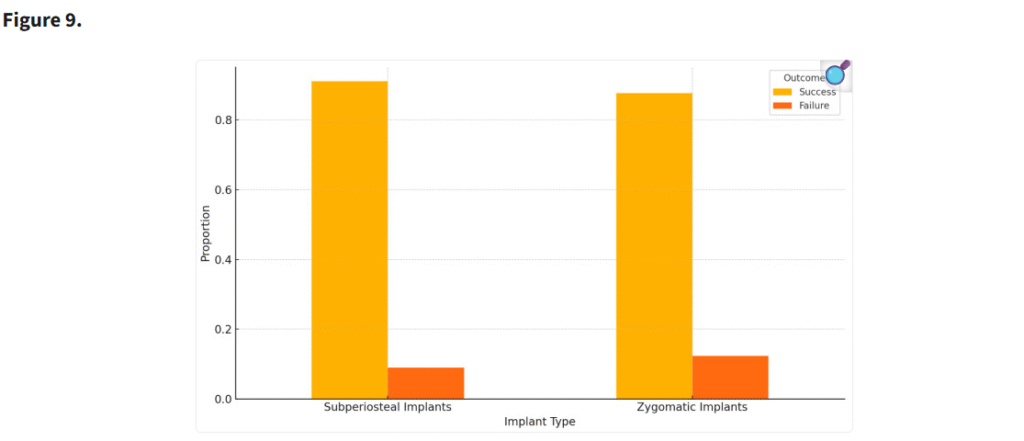
骨膜下インプラントとザイゴマインプラントの成功率および失敗率を比較した棒グラフ。p値:0.65 は、提供されたデータに基づき、両者の成功率と失敗率の間に統計学的に有意な差がないことを示している。
3.2. 手術時間
ザイゴマインプラントの埋入はより短時間で行うことができたが、個別設計インプラントの精緻な埋入は高い精度と安定性を確保し、手術時間がやや長くなる一方で長期的な合併症を減少させる結果となった。ザイゴマインプラントはテンプレートを用いずフリーハンドで埋入されたのに対し、一部の個別インプラントはテンプレートを用いてガイド下に埋入された。個別インプラントにおいて手術時間が長くなったのは、骨をテンプレートに適合させるための調整が必要であったためである。さらに、骨膜下インプラントでは下顎外斜線(linea obliqua)からの骨移植が併用された症例もあり、これによっても手術時間が延長した(Figure 10)。
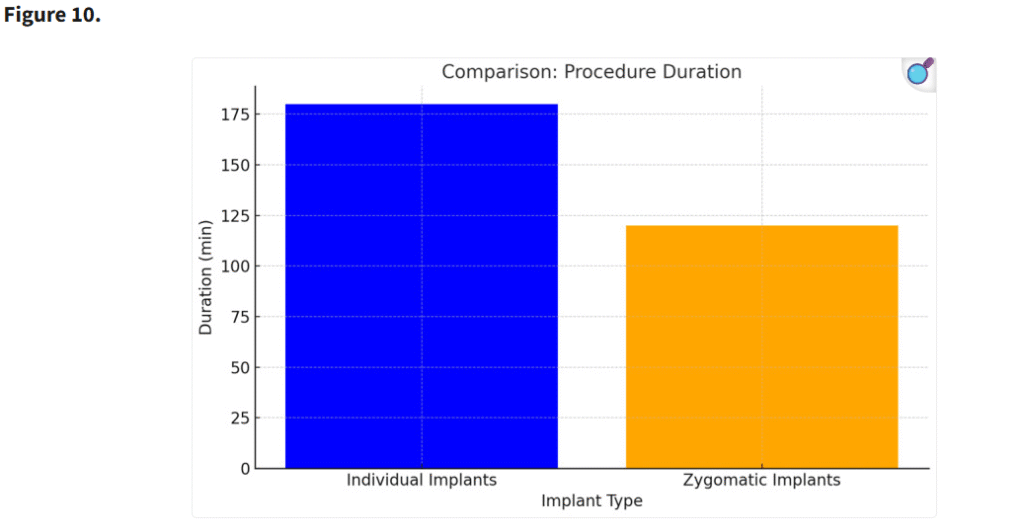
個別インプラントの手術時間が長くなったのは、骨をテンプレートに適合させるための調整が必要だったためである。さらに、骨膜下インプラントでは、斜線からの骨移植が行われ、手術時間はさらに延長された(p < 0.05)。
3.3. 上顎洞の術後病変
個別設計インプラントを使用した患者は、ザイゴマインプラントを使用した患者と比較して、術後の上顎洞病変の発生が少なかった(p < 0.05)。個別インプラントの設計と埋入手技により、上顎洞粘膜の穿孔やそれに関連する合併症のリスクが最小限に抑えられた(Figure 11)。
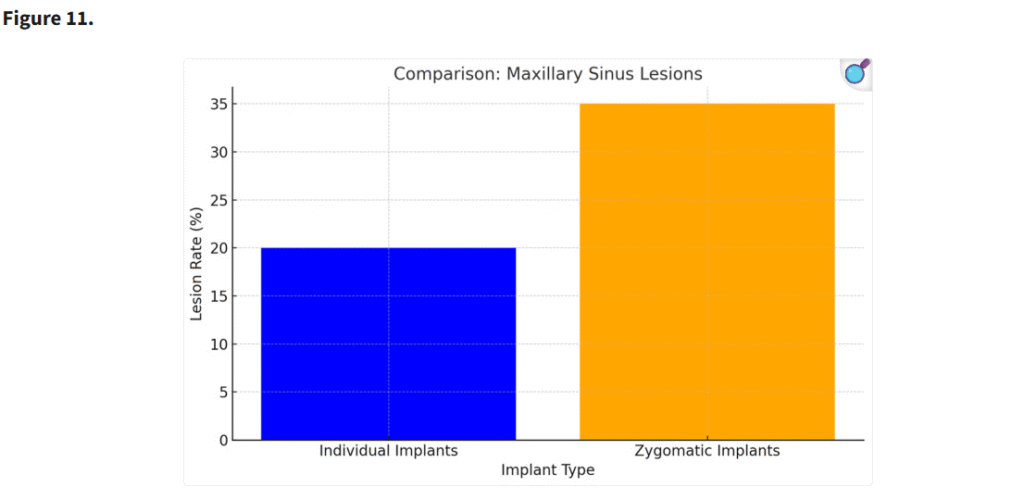
個別インプラントの設計および埋入手技は、上顎洞膜穿孔およびそれに伴う合併症のリスクを最小限に抑えた(p < 0.05)
3.4. 軟組織退縮
個別設計インプラントでは、ザイゴマインプラントと比較して軟組織退縮の発生頻度が有意に低かった(p < 0.05)。個別インプラントの精密な設計と埋入位置により、軟組織の統合が向上し、審美的な結果も改善された(Figure 12)。
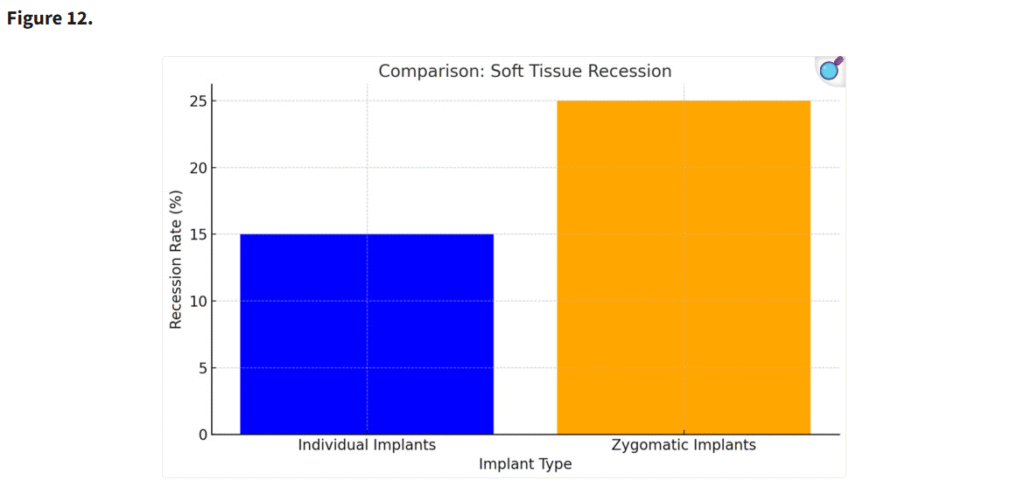
エクストラマキシラリー法によるザイゴマインプラント埋入は、軟組織裂開のリスクが高い(p < 0.05)。
3.5. 術後粘膜の厚さ
術後の粘膜厚は、個別設計インプラントを使用した患者でより安定していた。個別インプラントに伴う周囲構造への機械的ストレスの軽減が、術後成績の改善に寄与したと考えられる(p < 0.05)(Figure 13)。
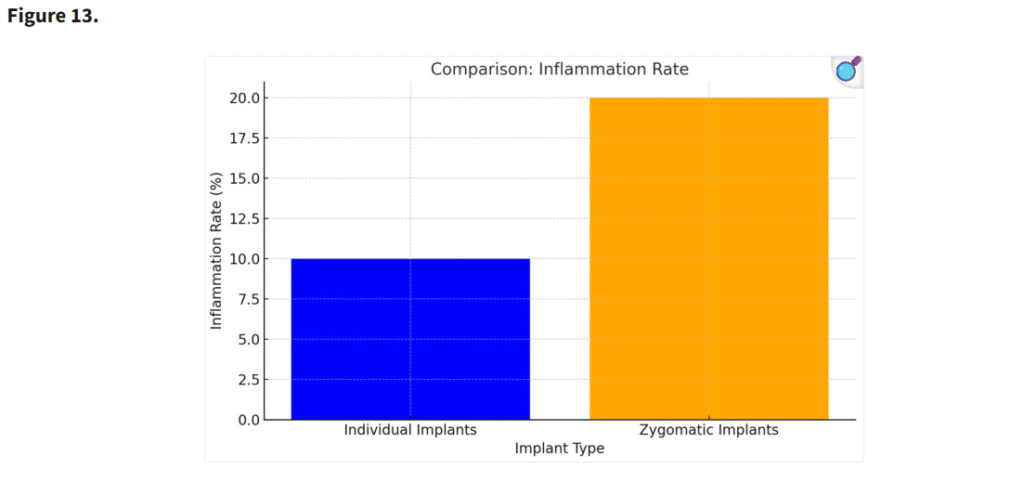
エクストラマキシラリー法によるインプラント埋入に関連した副鼻腔炎は、臨床的にザイゴマインプラント周囲で観察される炎症およびCBCT画像上の炎症の原因である(p < 0.05)
3.6. 炎症およびインプラントの動揺
個別設計インプラントを使用した患者では、ザイゴマインプラントと比較して炎症およびインプラントの動揺が著しく低かった。個別インプラントの高い安定性と生体適合性が、これらの合併症の軽減に寄与したと考えられる(p < 0.05)(Figure 14)。
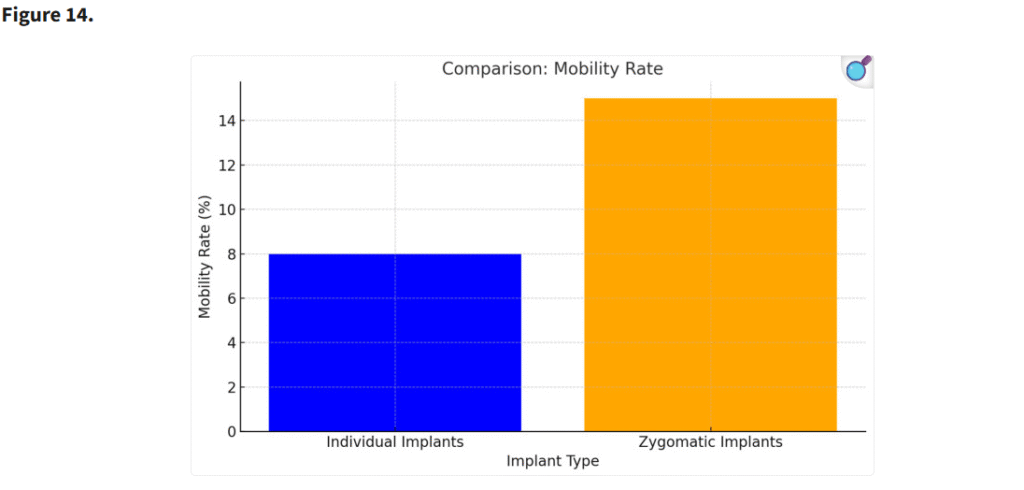
ザイゴマインプラントのザイゴマ骨への固定は、カンチレバー効果を生じさせる。その結果、歯科用器具で圧力を加えた際に、ザイゴマインプラントの遠位端で動揺が顕著となる。(p < 0.05)